- Avem 7 straturi în învelișul de electroni: K, L, M, N, O, P, Q (1-7), de la 1 la 7 crește numărul maxim de electroni și energia electronilor(aceasta deoarece scade forța electrostatică dintre nucleu și electroni)
- Fiecare strat se completează cu substraturi formate de orbitali(spațiul din jurul nucleului în care sigur există electroni). Avem 4 tipuri de orbital:
- s - într-un strat exista un singur orbital de acest tip și se completează cu maxim 2 electroni
- p - într-un strat există 3 orbitali de acest tip care se completează cu maxim 6 electroni
- d - Într-un strat există 5 orbitali de acest tip care se completează cu maxim 10 electroni
- f - Într-un strat există 7 orbitali de acest tip care se completează cu maxim 14 electroni
Obs: după cum observați într-un orbital pot exista maxim doi electroni cu spin opus(adică unul se mișcă în sens orar și altul în sens antiorar sau invers) numiți electroni cuplați.
- Stratul K(1) are un substrat⇾ 1s-maxim 2 electr.
⇘ 2p-max 6 electr. => max 8 electr.
Stratul M(3) are 3 substraturi ⇾ 3s-max 2 electr.
⇘ 3p-max 6 electr. => max 18 electr.
⤷ 3d-max 10 electr.
ș.a.m.d.
- Exemple:
*unde vom avea o săgeată de la penultimul la ultimul strat are loc un salt electronic, pentru ca configurația să fie mai stabilă
*pentru a nu trebui de numărat de fiecare dată electronii:







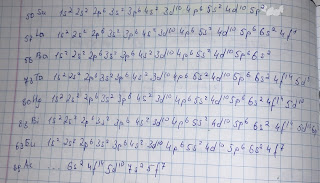

Niciun comentariu:
Trimiteți un comentariu